
(Foto: Jorge Guadalupe/Arquivo Pessoal)
Pesquisador lagopratense participa de criação de carne em laboratório da UFMG
O biólogo lagopratense Jorge Guadalupe, formado pela UFMG e pesquisador do Instituto de Ciências Biológicas (ICB), participou de um projeto de criação de carne de frango em laboratório. A pesquisa foi desenvolvida junto a alunos e professores da UFMG e do Cefet-MG.
Ao Sou+Lagoa, ele contou sobre a formação do grupo de pesquisadores e o desenvolvimento da pesquisa. Participaram, junto a ele, três professores e oito alunos de diferentes níveis: da graduação ao pós-doutorado. Jorge está no mestrado e já havia feito parte do laboratório em projetos de iniciação científica.
“No começo da graduação entrei no laboratório da Professora Dra. Luciana Andrade, que é uma das líderes da pesquisa. Ela queria trabalhar com engenharia de tecidos, que é você fazer tecidos não só de músculo esquelético, mas músculos como o coração, [tecidos como a] pele etc. A ideia inicial era entender o coração para [estudar] a doença de chagas”, contou. A integração de outros pesquisadores foi fundamental para determinar os rumos da pesquisa; a aluna Ana Elisa Antunes, do Cefet-MG, já possuía uma startup de engenharia de tecidos.
O projeto foi financiado pelo Good Food Institute (GFI) e liderado pelos professores do Cefet-MG Aline Bruna da Silva e João Paulo Ferreira Santos, do departamento de Engenharia de Materiais, junto às professoras Luciana Andrade e Érica Cristina Jorge do ICB – UFMG. O biomaterial da pesquisa foi produzido no Cefet-MG e testado para criação do tecido muscular na UFMG.

Segundo Jorge, a ideia de criar a carne cultivada, como é chamada, não seria a substituição no mercado, mas uma alternativa à carne convencional para criar um futuro mais sustentável. O mercado agropecuário é um dos líderes da degradação ambiental, principalmente graças à emissão de gases estufa e desmatamento causados pela criação extensiva de gado.
A pesquisa foi selecionada em 2021 e financiada através de um edital da instituição filantrópica GFI, que financia projetos sustentáveis. O princípio da pesquisa era desenvolver um biomaterial onde as células pudessem se multiplicar tridimensionalmente. Além disso, tinham o objetivo de criar uma carne composta por células musculares e gordura.
“A carne não é só músculo, o que dá sabor inclusive é a gordura. Então são precisas células musculares e de gordura simultaneamente, só que isso é muito difícil porque são células que precisam de um meio específico para crescer e moléculas específicas para amadurecer, diferente do que o tecido adiposo precisa. O que a gente propôs foi colocar partículas que já tinham óleo vegetal”, relatou o pesquisador.
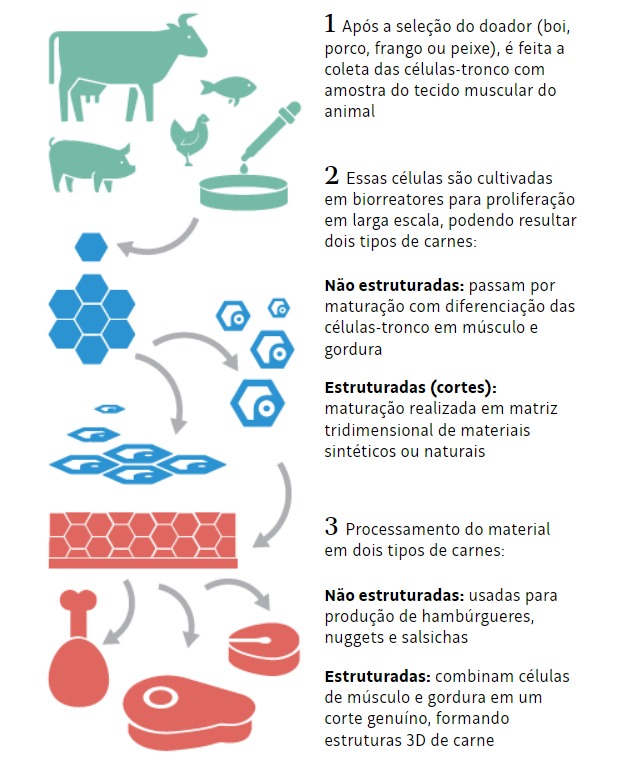
Jorge explicou que as células precisam se multiplicar tridimensionalmente, acompanhando a estrutura do biomaterial criado por eles, chamado de scheffold (andaime).
“Esse biomaterial, na pesquisa, é a base de acetato de celulose, uma celulose modificada – acessível, biodegradável e comestível”, explicou.
O projeto, em fase de laboratório, teve dois anos de desenvolvimento e termina em outubro. O objetivo é enviar outro projeto, que pode escalonar e levar a produção de carne cultivada para a fase industrial. Jorge ainda explicou a possibilidade de que os produtos dessas pesquisas sejam comprados por empresas interessadas, já que todos os projetos têm um cunho de articulação entre pesquisa e indústria.
“Gigantes do agronegócio como a JBS estão investindo na alternativa da carne cultivada. É um mercado crescente porque a população vai crescer e não terá espaço cultivável o suficiente”, explicou Jorge. A estimativa é que em 2050, a população seja de 10 milhões de pessoas e não haverá espaço para terras aráveis.
Dentro do projeto, Jorge era responsável pela caracterização e validação do biomaterial no desenvolvimento de um tecido muscular maduro, para que a outra pessoa pudesse substituir pela célula do frango e produzir um bife.
Há ainda muitos desafios a serem desenvolvidos a partir dessa pesquisa, um deles seria o alto custo do meio de cultura necessário para a proliferação das células. Além disso, conseguir células que tenham alta capacidade proliferativa sem modificá-las geneticamente, já que essas alterações podem não ser aceitas pelos órgãos regulamentadores.




